Половая система клеща

Для возбудителя половая система есть система выведения, продолжения существования патогена не столько в пространстве, сколько во времени без существенного изменения параметров среды для микроорганизма.
Только очень небольшое число возбудителей, видимо, наиболее близкие по происхождению к симбионтам могут неопределенно долго (в масштабе времени жизни экспериментатора) сохраняться при трансовариальной передаче: таковы некоторые бабезии и боррелии клещевого рекурренса. Правда, в обоих случаях подпитывание клещей в ряде поколений не исключает дозаражение на больных прокормителях (или паразитоносителях) и обновления генофонда обладающих исключительной способностью к трансовариальной передаче возбудителей.
С Borrelia burgdorferi в иксодовых клещах дело обстоит далеко не так благополучно, как с трансовариальной передачей боррелий аргазидами. Несмотря на высокое сродство этого возбудителя к тканям яичника, где они встречаются до, во время и после яйцекладки, эти боррелии тормозят созревание оогоний. В их присутствии тормозится развитие микроворсинок и хитинообразование яйцеклетки, нарушается образование оболочки яйца. Объем кладки и выплод из яиц у зараженных Ixodes dammini понижен (Hayes, Burgdorfer, 1992).
Нет надобности останавливаться на описании половой системы клещей, оно достаточно подробно изложено в монографии Ю. С. Балашова (1967) и в соответствующих разделах монографии по физиологии иксодовых клещей («Physiology of ticks», 1982). Разберем лишь те детали и функции этой системы, которые имеют наибольшее значение для трансовариальной передачи возбудителей.
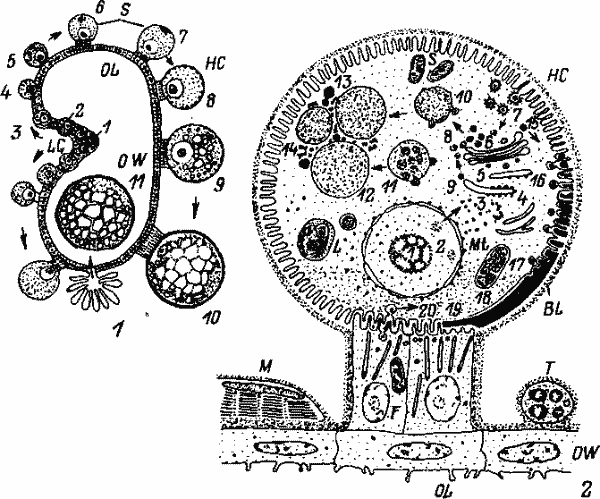
Обобщенная схема оогенеза (1) и схема развития ооцита (2) иксодоидного клеща (по: Diehl et al., 1982):
F—стебелек ооцита с межпальцевыми микроворсинками, связывающими ооцит со стенкой яичника, микротрубочки в нем—опорный цитоскелет; OW — стенка яичника; OL — просвет яичника; LG — продольный желобок; НС — гемоцель; 5 — симбионты; М — мышцы; Т — трахеола и трахеи, примыкающие к базальной пластинке (BL), которая отделяет ооцит от гемоцеля; L — лизосомы; Mt — митохондрии. Цифровые обозначения на рис. 25, 1: 1—7 — фазы роста цитоплазмы, ядра и ядрышка, выпячивание ооцита из стенки яичника; 8—10— период интенсивного накопления желточных протеинов (витоллогенинов), к концу этой фазы ядрышко исчезает, хромосомы конденсируются в кариосферу, 11 — овуляция, ооцит в просвете яичника (место прикрепления стебелька имеет вид истонченной оболочки, покрывающей ооцит). То же на рис. 25, 2: 1 — ядро ооцита с вакуолизированным ядрышком; 2— массы рибонуклеидов, выходящие из ядра и формирующие вне его рибосомы или полисомы; 3—рибосомы, полисомы; 4, 5—эндоплазматический ретикулум, на котором синтезируется желток яйца; 6 — аппарат Гольджи, от которого отделяются небольшие везикулы; 7—покрытые оболочкой, отделяющиеся от богатой микроворсинками мембраны ооцита, усваиваемые внутри клеток предшественники желтка или гемолимфы; 8 — везикулы, образуемые из различных источников; 9— эндоплазматический ретикулум, от которого отделяются небольшие везикулы; 10— большие вакуоли из сплавившихся малых везикул (8); 11 — тела с множеством вакуолей (мультивезикулярные тела); 12 — обширные гранулы желтка, образующиеся из-за слияния везикул и расширения мембран мультивезикулярных тел; 13—богатые триглицеридами липидные включения; 14—гликоген; 15 — везикулы, содержащие белки — предшественники оболочки ооцита, продуцируемые аппаратом Гольджи; 16 — слившиеся в мембране везикулы с белками предшественниками оболочки ооцита; 17 — полимеризующиеся предшественники белков оболочки в межворсинковом пространстве, втягивающиеся микроворсинки; 18 — образующаяся оболочка яйца; 19 — более тонкая оболочка в области стебелька ооцита; 20 — пиноцитирование материала стебелька ооцита и переход его в ооцит